Deixem os radicais serem livres
Eu tenho um amigo artista que adora ver fractais nas coisas – esses padrões que se repetem na natureza entre escalas macro e micro, sabe!? Esse meu amigo me fez pensar num fractal que beira uma piada infame: os radicais livres.
O escritor de sci-fi Isaac Asimov já fez comparação parecida de populações humanas e de moléculas e até que faz algum sentido. Pense bem: os radicais políticos da nossa sociedade são como moléculas instáveis, altamente reativas, cujas opiniões e atitudes conseguem se alastrar rapidamente, colocando fogo em mentes e corações – e eventualmente em coisas. Em certo sentido poderia se dizer também que frequentemente são “fogo-de-palha”: o radicalismo disseminado se aquieta tão rápido quanto se alastra, com uma área de ação limitada. Em ambos os casos chamamos esses “altamente reativos e instáveis” sujeitos de “radicais livres”.
Da mesma maneira que um radical político é aquela pessoa que se torna “extrema” por carregar a convicção muito forte de que há algo muito estranho na sociedade, os radicais livres também têm algo incomum que os deixa extremamente reativos: elétrons. Quando uma molécula fica com um elétron desemparelhado (geralmente por quebra homolítica de ligações) ela se torna um radical, uma molécula que não está dentro da regra do octeto e que por isso com muita pouca energia é capaz de reagir com outras moléculas, formando novos radicais – igual seres humanos, só que com regras bem mais complexas.
Radicalizando contra os radicais
Como deu para perceber com os amigos e familiares com quem você talvez tenha brigado nessas últimas eleições, radicais geram radicalismos também na “direção oposta”. Se a natureza é uma das principais fontes de radicais livres, o radicalismo oposto é a vida, que conseguiu sobreviver a opressores raios UV, raios gamma e os mais variados compostos oxidativos até se diversificar e milhões de anos depois acabar sendo capaz de ler esse texto. Talvez o melhor exemplo desse radicalismo anti-oxidativo que a vida se tornou são as bactérias do gênero Deinococcus.
Uma das bactérias mais famosas desse gênero é a Deinococcus radiodurans, que sobrevive a uma quantidade de radiação gamma (a mesma que gerou o Íncrível Hulk) 20000 vezes maior do que a permitida para astronautas em missões espaciais – e sem se tornar uma mutante. Isso só é parte da grande característica das bactérias do gênero Deinococcus de “radicalizar” na proteção a danos moleculares. No dano causado por radicais livres (danos oxidativos), que pode ser um efeito indireto da ação dos raios gamma, as espécies de Deinococcus possuem estratégias que vão além das usuais para se proteger de radicais livres: esses seres vivos diminuem seu tamanho celular eliminando água; com menos água, menor a probabilidade de se gerar espécies reativas de oxigênio provenientes das moléculas de H2O, além de “concentrar” o citosol de moléculas responsáveis por reagir e “conter” esses radicais livres – sim, os antioxidantes – que existem em grande quantidade nas Deinococcus.
No ponto de vista de “engenheirar” soluções biotecnológicas, entender os extremos é uma maneira importante de entender como as coisas “normais” funcionam, e como podemos resolver problemas com esse conhecimento. É um jeito de entender a nós mesmos. O mesmo vale para os radicais políticos.
Radicais livres, “malvados” e naturais
Igual ao termo “black block”, os radicais livres químicos também já são populares. Hoje é muito fácil encontrar embalagens de cosméticos e de “alimentos saudáveis” com os termos “antioxidantes naturais” que inibem os “radicais livres” – essas coisinhas químicas malvadas. A associação dos radicais livres com algo ruim é natural porque estão intimamente relacionados com o envelhecimento e o câncer [3] – duas coisas muito cotadas para ganhar dinheiro de pesquisa, inclusive se for para estudar isso nas Deinococcus.
Além de produzidos por radiação, eles são produtos naturais do nosso metabolismo aeróbio [4]. Desde quando a atmosfera terrestre passou a se tornar oxidante (por causa do oxigênio, há!) há milhões de anos [1], a vida começou a se tornar esse joguinho cada vez mais complexo de conduzir elétrons através de moléculas estranhas. É como um circuito eletrônico, em que os caminhos de condução devem estar isolados uns dos outros para evitar curto-circuito e o dispositivo realizar sua função. A célula é como um circuito com um isolamento quase perfeito, e é essa pequena falta de isolamento que faz os elétrons irem aonde não devem, formando radicais livres [1].
Parte da “função” desse fluxo eletrônico da célula, no final das contas, é armazenar informação. Você não é apenas um agregado aleatório de moléculas, você é um agregado de moléculas com uma certa ordem e arranjo específicos, e isso é informação. O envelhecimento é causado por perda dessa ordem ao longo do tempo, e os maiores culpados disso até agora são os radicais livres. Eles reagem com o DNA podendo causar mutações e estão associados diretamente com o encurtamento dos telômeros [3] (que é uma espécie de “medida” de idade celular). Essa perda de informação se dá até de outra maneira (ainda mais literal) com a ação dos radicais livres em proteínas, como no caso do Alzheimer. Nesse caso os radicais livres contribuem para a formação de agregados proteicos tóxicos nas células do cérebro, associados com o desencadeamento da doença.
O bom é o equilíbrio
Apesar da doença de Alzheimer, radicais livres no cérebro não geram apenas danos. O radical livre óxido nítrico (NO) por exemplo, é um neurotransmissor regulador cardiovascular muito potente – tanto que o Viagra interfere no mecanismo de regulação mediado naturalmente pelo NO para ter seu efeito. A visão dos radicais livres como simplesmente vilões começou a mudar com o radical superóxido (molécula de oxigênio com um elétron a mais) que deixou de ser considerado meramente como um subproduto nocivo do metabolismo para ser uma das peças fundamentais na bioquímica do sistema imunológico. Hoje sabemos que vários genes são diretamente regulados por ação de radicais livres que interagem com fatores de transcrição para a ativação e/ou inibição da expressão gênica [3], em outras palavras: os radicais livres não são meras fontes de dano que levam à morte, mas estão profundamente ligados com a própria regulação da vida em si.
Indo de volta para a visão macro do nosso “fractal”, os radicais políticos teriam papel semelhante: são mais do que membros “extremistas”. Eles estão ligados profundamente com a regulação da própria política em si. São, assim como os radicais livres químicos, algo do que a sociedade precisa se proteger mas ao mesmo tempo algo que faz parte do seu próprio sistema imunológico. São os radicais que chamam a atenção, seja para a direita ou para a esquerda, de que algo precisa ser debatido. São os vistos como “radicais” que têm a coragem de entrar no campo cinzento da moralidade para redefini-lo com o tempo. Sobretudo, são os radicais que são a melhor indicação da saúde política: havendo um certo equilíbrio e limites, são a caricatura de uma pluralidade e flexibilidade política que uma democracia precisa ter.
Esse é o meu ponto como advogado-do-diabo dos radicais livres. Precisamos entendê-los como sujeitos de um equilíbrio natural. Por isso, assim como é errado chamar qualquer manifestante de “black block” sem ao menos saber o que é isso, é também errado para radicais livres específicos chamá-los de “ROS” (reactive species of oxygen) sem saber direito o que de fato esses radicais fazem. É como a pesquisadora principal do CEPID Redoxoma, Ohara Augusto, menciona na newsletter do grupo:
…abreviações são úteis quando têm significados específicos. ROS não é verdadeiramente uma abreviação porque agrupa moléculas com propriedades químicas e biológicas completamente diferentes.
Ou seja: é errado colocar tudo num mesmo saco porque isso pode acabar atrapalhando o entendimento das coisas. Assim como posicionamentos políticos podem ter os mais variados espectros, os radicais livres podem ter as mais diferentes reatividades, estruturas e fontes de produção – tornando-os na prática bem diferentes uns dos outros (veja na figura abaixo).
Bons ou maus, úteis ou inúteis, tudo isso depende do contexto, e o principal contexto é entendê-los melhor, saber como eles funcionam – sendo radicais químicos ou políticos. Por isso, vamos parar de achar que a existência de radicais é algo errado. Independentemente do que achamos deles, a natureza é muito mais do que esse preto-no-branco. Ela é livre para ser esse incrível caos organizado – então deixem os radicais serem livres também!
Referências
[1] McCord, Joe M. “The evolution of free radicals and oxidative stress.” The American journal of medicine 108.8 (2000): 652-659.
[2] Slade, Dea, and Miroslav Radman. “Oxidative stress resistance in Deinococcus radiodurans.” Microbiology and Molecular Biology Reviews 75.1 (2011): 133-191.
[3] Kim, Hyon Jeen, et al. “Modulation of redox-sensitive transcription factors by calorie restriction during aging.” Mechanisms of ageing and development 123.12 (2002): 1589-1595.
[4] Ohara Augusto and Sayuri Miyamoto. “Oxygen Radicals and Related Species”. Principles of Free Radical Biomedicine. Vol. 1, chapter II (2011).
Por que ATP!?
![]()
A maioria das pessoas que sabe um pouquinho de bioquímica aprende que o ATP é a “moeda energética” da célula. Maravilha. Mas aposto que se você perguntar o porquê disso, a resposta-padrão vai ser: “É porque é uma molécula muito energética, presente em reações de catálise e regulação de diversas enzimas na célula e blá-blá-blá…”. Lindo. Mas existem muitas moléculas muito energéticas no universo, e argumentar que o ATP é a “moeda energética” simplesmente porque as pessoas descobriram que na natureza ele está presente em várias reações enzimáticas acaba sendo um jeito bastante sofisticado de dizer “porque sim, zequinha!”.
[youtube_sc url=”https://www.youtube.com/watch?v=8Wldlug58Kc”]
Como construir um regulador enzimático e transportador energético na célula!?
Seguindo o espírito de engenheirar o metabolismo, como poderíamos, conhecendo as características físico-químicas dos elementos e compostos químicos, construir algo que seja como o ATP: uma coisa que regule de maneira sistêmica as atividades enzimáticas da célula, armazene energia e que seja fácil de se armazenar e ao mesmo de se usar!?
Bem, vamos pensar em energia como dinheiro: digamos que você seja rico, muito rico. Com muito dinheiro, a probabilidade de que você seja roubado é bem maior. Para que você mantenha sua riqueza é preciso que ela seja armazenada de um jeito “estável” (doce ilusão, mas considere isso como verdade, ok?) e por isso você coloca o seu dinheiro no banco. Você precisa proteger seu dinheiro e ainda acessá-lo facilmente – colocar tudo num baú e enterrar numa ilha desconhecida não vai ajudar na funcionalidade do seu dinheiro.
O mesmo funciona para a nossa moeda energética: ela não pode ser um composto cuja energia possa ser facilmente “roubada” por qualquer espécie química, mas também não pode ser pouco reativa a ponto de não conseguir regular a atividade enzimática e a transmissão energética. É preciso ter o controle desse “dinheiro” para gastá-lo facilmente onde você precisa: na manutenção da vida celular.
Então temos três coisas principais para a nossa molécula-moeda-energética: ela precisa ser estável o suficiente para que a energia não se “esvaia” facilmente, não tão estável a ponto de ser difícil usá-la e ainda reagir facilmente com proteínas.
Candidatos
Sabemos experimentalmente que o fosfato do ATP é a molécula-moeda. Mas porque só ela? Será que não tem nenhuma outra molécula que poderia fazer isso? Não poderia existir nenhuma outra coisa (ou coisas) alternativa que pudesse substituir o ATP ou que possa estar fazendo a mesma coisa?
Para encontrar um substituto (ou equivalente) para o ATP é preciso explorar análogos estruturais e energéticos dessa molécula. Selecionei dois possíveis candidatos:
TriSulfonatos
Da mesma forma que o ATP é um TriFosfato, porque ele não poderia ser um trisulfonato? A estrutura é bem similar e as energias das ligações éter (a ligação S – O – S) são bem parecidas também (veja). Além disso, sabe-se que há resíduos de aminoácidos que sofrem sulfonização.
Arsênico
Do mesmo jeito que teorizam as diferentes maneiras da vida ter surgido no universo, porque não  poderíamos ter um “ATP de Arsênico”!? O Arsênico fica logo abaixo do fósforo na tabela periódica e por isso faz o mesmo número de ligações, além de formar arsenato (e com isso diarsenatos e triarsenatos), de estrutura bem parecida com a do fosfato.
poderíamos ter um “ATP de Arsênico”!? O Arsênico fica logo abaixo do fósforo na tabela periódica e por isso faz o mesmo número de ligações, além de formar arsenato (e com isso diarsenatos e triarsenatos), de estrutura bem parecida com a do fosfato.
Que o melhor ganhe
As reações que o ATP faz são reações de hidrólise: um fosfato tem sua ligação éter (O – P) quebrada resultando na fosforilação de alguma coisa. Essa ligação é de alta energia (em termos bioquímicos) e é espontânea (delta G negativo). Reações não termodinamicamente espontâneas que passam por uma etapa de fosforilação acabam se tornando espontâneas na soma geral da energia livre, como por exemplo na fosforilação da glicose:
(Imagem modificada da referência [6])
Apesar da reação de hidrólise ser espontânea, a fosforilação tem uma velocidade de reação suficientemente lenta para garantir a estabilidade que a “moeda energética” precisa para realizar reações úteis (não que hidrolisar e simplesmente gerar calor seja de todo inútil…).
Se eu conseguir mostrar que o arsenato ou o sulfonato são melhores em termos energéticos e cinéticos, um mundo novo de possibilidades bioquímicas se abrirá!
Pesquisei alguns dados na internet e montei a seguinte tabela:
(Dados retirados das refs [1], [2], [3] e [4])
O quão maior for a constante de hidrólise (k) da reação, mais rápida ela será. Com esses dados dá para ver claramente que o fosfato é um “banco energético” bem mais confiável que os arsenato e o sulfato, sendo cerca de 100000 vezes mais estável que estes dois últimos – mantendo sua facilidade de “uso” energético com o delta G de hidrólise negativo. O fosfato é, além disso, bem mais “rico” que os seus concorrentes.
O sulfato, apesar de ser um candidato tentador, é bem mais difícil se “ser um ATP” como o arsenato pode ser. Não consegui encontrar nenhuma molécula como a proposta na imagem anterior, apenas dissulfonatos – e ainda não ligados a uma adenosina! Mesmo que houvesse um “ATP de enxofre”, seria difícil que ele assumisse o papel de controle das atividades enzimáticas porque ele não reage com resíduos de aminoácidos tão bem como o arsenato e o fosfato.
O arsenato já ganhou espaço na mídia a algum tempo atrás com o suposto encontro de uma “vida baseada em arsênico” na terra. Existem de fato várias enzimas que se ligam a arsenato e ele consegue substituir o fosfato em muitos casos, mas causando efeitos tóxicos na célula ao competir com o fosfato para a fosforilação de moléculas durante o catabolismo. Mesmo que houvesse um organismo em que a toxicidade fosse tolerada, a eficiência do processo de “arsenização” seria pífia: muitas moléculas apenas iriam hidrolisar espontaneamente de maneira “inútil”, liberando calor – além de tudo isso, eu nem preciso argumentar a questão a abundância do Arsênico no meio ambiente!
Não é porque sim!
Enfim, agora estou convencido do porquê o ATP é como é: o fósforo e as ligações éter o fazem um composto único, com propriedades flexíveis e ideais para ser o transmissor de energia de compostos mais energéticos do metabolismo até os menos energéticos, fazendo reações termodinamicamente não-espontâneas acontecerem e regulando de maneira sistêmica todo o conjunto de milhares de enzimas das células que dependem da fosforilação para alternarem entre seus estados ativos e inativos.
Portanto, da próxima vez que você não encontrar a resposta que queria, é melhor tentar construir o que você não entende – afinal, qual seria melhor jeito de entender alguma coisa no final das contas!?
Referências
[1] Rosen, B., Ajees, A., & McDermott, T. (2011). Life and death with arsenic BioEssays, 33 (5), 350-357 DOI: 10.1002/bies.201100012
[5] Tabelas de Entalpias de Ligação
[6] Nelson, David L., Albert L. Lehninger, and Michael M. Cox. Lehninger principles of biochemistry. Macmillan, 2008.
CRISPR: nova e revolucionária técnica para edição de genoma
 Ter o genoma sequenciado por apenas 1000 dólares em breve será uma realidade. E não é somente ler o genoma que está se tornando cada vez mais acessível, descobertas recentes resultaram em uma nova ferramenta de edição de genoma que promete revolucionar a pesquisa médica e o tratamento de algumas doenças. Este mecanismo, chamado de CRISPR, é baseado num sistema de defesa contra vírus, uma espécie de sistema imunológico, encontrado em bactérias. E mais uma aprendemos algo interessante com estes seres unicelulares (discutimos num post anterior como bactérias podem ajudar a combater o cancer).
Ter o genoma sequenciado por apenas 1000 dólares em breve será uma realidade. E não é somente ler o genoma que está se tornando cada vez mais acessível, descobertas recentes resultaram em uma nova ferramenta de edição de genoma que promete revolucionar a pesquisa médica e o tratamento de algumas doenças. Este mecanismo, chamado de CRISPR, é baseado num sistema de defesa contra vírus, uma espécie de sistema imunológico, encontrado em bactérias. E mais uma aprendemos algo interessante com estes seres unicelulares (discutimos num post anterior como bactérias podem ajudar a combater o cancer).
Editando o genoma para curar doenças
Tornar o tratamento de desordens genéticas é sem dúvida uma das mais excitantes possibilidades desta nova técnica, principalmente disordens causadas por uma ou poucas mutações, tais como doença de Huntington. Para comprovar que isto pode ser feito, cientistas do MIT, em experimentos em camundongos, conseguiram curar em uma doença rara que ataca o fígado e é causado pela mutação de apenas um par de base de DNA. Esta doença, que também ocorre em humanos, afeta 1 em cada 100.000 pessoas e consiste na falha da quebra do aminoácido tirosina que acumula e afeta o funcionamento do fígado. Utilizando a técnica de CRISPR os cientistas conseguiram corrigir o gene para 1 em cada 250 células do figado (hepatócitos) dos camundongos. Depois de 30 dias estas células proliferaram e substituiram parte das células com o gene defeituoso chegando a um terço da população total de células, o que foi suficiente para curar a doença. Veja o artigo publicado na Nature.
Mecanismo básico das ferramentas de edição de genoma
 Basicamente, o mecanismo de edição de genoma consiste em um sistema para reconhecer o sítio onde haverá a mudança combinado a um mecanismo de corte do DNA (nucleases). Uma vez reconhecido o local de corte as nucleases agem fazendo um corte nas duas fitas do DNA. Uma vez cortado, mecanismos de reparação do genoma tendem a juntar as fitas novamente e neste processo um pedaço de DNA pode ser removido ou até mesmo trocado por outro pedaço de DNA.
Basicamente, o mecanismo de edição de genoma consiste em um sistema para reconhecer o sítio onde haverá a mudança combinado a um mecanismo de corte do DNA (nucleases). Uma vez reconhecido o local de corte as nucleases agem fazendo um corte nas duas fitas do DNA. Uma vez cortado, mecanismos de reparação do genoma tendem a juntar as fitas novamente e neste processo um pedaço de DNA pode ser removido ou até mesmo trocado por outro pedaço de DNA.
As primeiras técnicas desenvolvidas, tanto Zinc finger nucleases quanto TALEN, utilizam proteínas para reconhecer o sítio de corte no genoma. Proteínas são pesadas e díficeis de projetar, diferentemente de RNA que pode ser facilmente sintetizado. E é aí que está a grande inovação da técnica de CRISPR, em utilizar pequenos pedaços de RNA para identificar o sítio de corte, o que torna a técnica simples e de baixo custo.
Recomendo os seguintes vídeos/animações para uma ilustração do mecanismo de edição de genomas. O primeiro video (em inglês) fala um pouco sobre os mecanismos gerais destas técnicas. O segundo vídeo (também em inglês) ilustra o mecanismo baseado na CRISPR.
Referência:
Bactérias na guerra contra o câncer
 Vimos num post anterior, que bactérias idênticas em seu DNA podem tomar diferentes decisões quando estão sobre stress tais como escassez de alimento. Diversas estratégias tais como ficar dormentes (esporulação), entrar em competência ou até mesmo canibalismo são utilizadas para aumentar as chances de sobrevivência da colônia. Nos últimos anos, tem aumentado o número de evidências de que células cancerígenas agem de maneira bastante semelhante. Utilizando um avançado sistema de cooperação e comunicação celular, estas células são capazes de se espalhar pelo corpo colonizando novos órgãos (metástase) ou resistir a ações clínicas tais como quimioterapia. Uma das maneiras de resistir a quimioterapia, por exemplo, é pela estratégia de tornar-se “dormente” adotada por algumas das células do tumor, processo análogo a esporulação das bactérias.
Vimos num post anterior, que bactérias idênticas em seu DNA podem tomar diferentes decisões quando estão sobre stress tais como escassez de alimento. Diversas estratégias tais como ficar dormentes (esporulação), entrar em competência ou até mesmo canibalismo são utilizadas para aumentar as chances de sobrevivência da colônia. Nos últimos anos, tem aumentado o número de evidências de que células cancerígenas agem de maneira bastante semelhante. Utilizando um avançado sistema de cooperação e comunicação celular, estas células são capazes de se espalhar pelo corpo colonizando novos órgãos (metástase) ou resistir a ações clínicas tais como quimioterapia. Uma das maneiras de resistir a quimioterapia, por exemplo, é pela estratégia de tornar-se “dormente” adotada por algumas das células do tumor, processo análogo a esporulação das bactérias.
Atualmente, desvendar o sistema de comunicação utilizado por células cancerígenas tem sido foco de inúmeras pesquisas. Como em qualquer guerra moderna, destruir o sistema de comunicação inimigo pode causar grandes danos. E na guerra contra o câncer provavelmente não será diferente. Impedir as células de se comunicarem pode evitar que elas adotem estratégias inteligentes tais como ficarem dormentes durante quimioterapia ou até mesmo matar células irmãs para obtenção de alimento. Uma vez entendido a linguagem utilizada por estas células, podemos utilizar isto ao nosso favor, interferindo nas mensagens e fazendo com que células dormentes sejam acordadas durante a quimioterapia ou até mesmo induzir as células cancerígenas a matarem umas as outras.
Finalmente, uma possível estratégia futura seria recrutar bactérias para derrotar o câncer. Elas poderiam ser utilizadas para “ensinar” as células do sistema imunológico a reconhecer e matar as células cancerígenas. É importante ressaltar que ainda compreendemos muito pouco sobre os mecanismos envolvidos no câncer e novas abordagens são necessárias para superá-lo. Entretanto, quem sabe num futuro próximo, estaremos em uma era de guerra cibernética biológica onde bactérias serão inteligentemente projetadas para derrotar o câncer.
Referências:
“Bacterial survival strategies suggest rethinking cancer cooperativity” Eshel Ben-Jacob, Donald S. Coffey, Herbert Levine. Trends in Microbiology. 2012.
“Bacterial linguistic communication and social intelligence” Eshel Ben-Jacob, Israela Becker, Yoash Shapira, Herbert Levine. Trends in Microbiology. 2004
Transposons: pedaços de DNA que mudam de endereço no genoma.
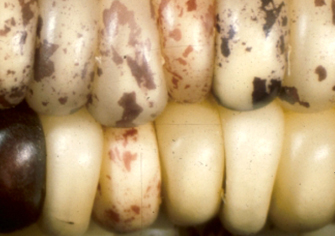
Mudança no padrão das cores do milho devido a interação entre os genes responsáveis pelo pigmento e elementos transponíveis.
Você sabia que alguns trechos de DNA têm a capacidade de mover-se no genoma, saindo de um cromossomo e se inserindo em outro? Pois é, e esta descoberta foi feita há muito tempo atrás por uma brilhante cientista, antes mesmo da descoberta da estrutura do DNA por Watson e Crick. Barbara McClintock ao observar a relação entre os padrões das cores do milho e algumas quebras cromossomais, percebeu que algumas destas quebras ocorriam com uma freqüência muito mais alta do que o esperado e, surpreendente, sempre no mesmo cromossomo. Após uma série de experimentos, a cientista percebeu que esta quebra ocorria devido a inserção de pedaços de DNA vindos de outros cromossomos que alteravam a expressão dos genes de pigmento. Confiante nos seus experimentos, Barbara então propôs que havia elementos transponíveis no genoma, ou seja, os genes não tinham um endereço fixo, mas tinham um mecanismo para movimentar-se dentro do genoma.
Se nos dias de hoje esta ideia parece bastante surpreendente, imagine como foi a recepção desta ousada ideia no começo da década de 50, quando a cientista começou a publicar seus resultados. Eles foram ignorados e ridicularizados pelos seus contemporâneos, levando a cientista a parar de publicar suas descobertas sobre o tema. Somente no início da década de 70 alguns elementos transponíveis foram identificados em bactéria validando assim a teoria de Barbara. Entretanto, o reconhecimento completo de uma das mais importantes descobertas da biologia somente aconteceu no início da década de 80, quando a cientista foi homenageada com o prêmio Nobel.
Atualmente vários estudos já relacionaram os elementos transponíveis, chamados de transposons, a uma série de doenças e como grande fonte de variabilidade genética. Hoje sabe-se que boa parte do genoma é composto destes elementos e dois mecanismos principais já foram identificados. O primeiro deles é um mecanismo de recortar-e-colar, onde alguns pedaços do DNA simplesmente saem de um lugar e movem-se para outra parte do genoma. O outro mecanismo é do tipo cortar-e-colar, gerando mais de uma cópia no genoma. Este último mecanismo é chamado de retrotransposons e consiste em quase metade do genoma humano e será tema de um próximo post.
FAQ #8 Como ver se a transformação gênica deu certo?
Já colocamos nossos plasmídeos nos bichinhos, mas ainda não acabou. Essa é a hora de saber se tudo que fizemos até aqui deu certo!
Primeiro, colocamos eles na placa de seleção com antibiótico e só aqueles que realmente incorporaram o plasmídeo vão sobreviver porque ganharam um gene amigo de resistência ao antibiótico. Agora pegamos uma parte das células sobreviventes e fazemos um teste usando a PCR (você lembra dessa técnica, né?).
Como testar com a PCR?! Roubamos os plasmídeos dessas células e tentamos multiplicar o pedaço de DNA que foi grudado nele adicionando primers, nucleotídeos e enzimas sob aquecimento e desaquecimento. Se o nosso plasmídeo modificado tiver sido incorporado pelos micro-organismos haverá a multiplicação do pedacinho e podemos vê-los em uma eletroforese. Caso contrário, nada foi copiado e nada vai aparecer na eletroforese. Então temos o sinal de que alguma coisa não deu certo por aqui e as chances de erros deste teste são bem pequenas.
Depois vamos para um teste melhor ainda, o sequenciamento. Este teste diz exatamente qual é a sequência de pares de base da molécula do plasmídeo e acabam de vez suas dúvidas se a transformação deu certo ou não! O sequenciamento começa parecendo um processo de duplicação normal de DNA. Mas além de cadeias molde, enzimas e nucleotídeos normais, há nucleotídeos especiais sintetizados (ddNTP’s) que possuem duas boas propriedades: emitem luz e interrompem o prologamento da cadeia a partir de onde foram adicionados. Então, imagine uma molécula de DNA que possui um par de base A-T em um determinado comprimento e considere que a base A pertence à cadeia molde e a base T à cadeia complementar. Se esta base T for um nucleotídeo especial temos como identificar “quem é” e “qual sua posição” na cadeia, pois ele emitirá uma cor específica para Timina e o comprimento de sua cadeia está interrompido na posição exata (nº 2 em verde).  Podemos detectar a cor emitida através de um espectrógrafo e a posição pelo tamanho revelado na eletroforese em gel (o sequenciador é basicamente a união dos dois). Ou detectar o tipo de nucleotídeo presente não pela cor, mas colocando os filamentos “lavados” por cada tipo de nucleotídeo em poços diferentes do gel e interpretando a sequência a olho nu/manualmente. Depois de identificado o nucleotídeo da cadeia complementar é possível saber quem ocupa a mesma posição na cadeia molde, no caso citado é a base Adenina. Expanda esse raciocínio para todas as outras bases da molécula, com uma amostra grande teremos cadeias de todos os comprimentos possíveis, interrompidas por um dos 4 tipos de nucleotídeos especiais (A, T, C, G), e assim é possível sequenciar toda a molécula de DNA!
Podemos detectar a cor emitida através de um espectrógrafo e a posição pelo tamanho revelado na eletroforese em gel (o sequenciador é basicamente a união dos dois). Ou detectar o tipo de nucleotídeo presente não pela cor, mas colocando os filamentos “lavados” por cada tipo de nucleotídeo em poços diferentes do gel e interpretando a sequência a olho nu/manualmente. Depois de identificado o nucleotídeo da cadeia complementar é possível saber quem ocupa a mesma posição na cadeia molde, no caso citado é a base Adenina. Expanda esse raciocínio para todas as outras bases da molécula, com uma amostra grande teremos cadeias de todos os comprimentos possíveis, interrompidas por um dos 4 tipos de nucleotídeos especiais (A, T, C, G), e assim é possível sequenciar toda a molécula de DNA!
Para saber mais sobre sequenciamento genético, clique aqui.
Por Otto Heringer e Viviane Siratuti.
FAQ #7 Como enfiar o plasmídeo nas células?
Dar e receber plasmídeos não é nenhuma novidade para algumas células!
As bactérias costumam trocar informações genéticas assim e esse processo é chamado de conjugação, portanto elas já possuem toda maquinaria necessária pra isso! Desse jeito elas aumentam muito a variabilidade e as chances de sobrevivência da população.
Podemos usar esse mecanismo natural para enfiar os plasmídeos, mas na maioria das vezes damos uma ajudinha usando choques térmicos ou elétricos.
Para entender o choque térmico, assista o vídeo do JOVE aqui. E do choque elétrico, aqui.
Por Otto Heringer e Viviane Siratuti.
FAQ #6 Como ver se nossos plasmídeos incorporaram os pedacinhos de DNA?
Sabendo o tamanho do plasmídeo e dos pedacinhos estimamos um tamanho para nosso novo plasmídeo e agora é só conferir se estão como esperado!
Para isso, existe uma técnica de separação chamada eletroforese em gel, onde as moléculas são “peneiradas” por algum polímero (gel de poliacrilamida ou de agarose) quando se movimentam atraídas ou repulsadas pelos eletrodos de cargas opostas que são colocados nas extremidades do gel. Ou seja, uma molécula com carga negativa caminha para o eletrodo de carga positiva e vice-versa. E as moléculas de mesma carga correm de maneiras diferentes pelo gel de acordo com seus pesos moleculares e tamanhos, as menores e mais “leves” passam com mais facilidade pelo gel enquanto as maiores e mais “pesadas” ficam mais retidas. No final, temos as moléculas separadas ao longo do gel e podemos comparar com a ladder (uma “régua” feita de moléculas com pesos e tamanhos já conhecidos) para saber se nossos plasmídeos estão no tamanho esperado.
Depois de confirmar pela eletroforese que nossos plasmídeos foram modificados, precisamos “salvá-los” do gel para colocar nas células. Basicamente, cortamos o pedaço de gel que está com nossos plasmídeos e colocamos em tubinhos com uma pequena coluna de sílica dentro (imagem aí embaixo). Então as moléculas de DNA se ligam à coluna, fazemos uma lavagem para tirar o gel e depois diluímos o DNA para retirá-lo da coluna!
Para saber mais sobre eletroforese, assista o vídeo do JOVE Science aqui e purificação aqui. 🙂
Por Otto Heringer e Viviane Siratuti.
FAQ #5 Como colocar os pedaços de DNA no plasmídeo?
Para abrir os plasmídeos (lembrando que é um DNA circular) e depois grudar os pedacinhos de DNA que extraímos pela Miniprep e multiplicamos pela PCR, usamos as chamadas enzimas de restrição e de ligação. Isso tudo ainda fora das células, ok?!
As enzimas de restrição reconhecem e cortam os plasmídeos em regiões específicas que queremos, isto é, cortam em determinadas sequências de pares de base. Inclusive existem dois tipos de corte, podendo formar extremidades coesivas (cortes em comprimentos diferentes entre as duas fitas) ou cegas (corte reto na dupla fita).
Feito isso, agora usamos as enzimas de ligação para grudar as extremidades dos plasmídeos às extremidades dos pedacinhos, onde as bases se complementam.
Legal saber também que o nome dessas enzimas estão sempre relacionados com os nomes dos organismos onde elas foram encontradas (veja a enzima EcoRI, por exemplo).
Para assistir o vídeo do JOVE Science sobre enzimas de restrição, clique aqui. E enzimas de ligação, aqui.
Por Otto Heringer e Viviane Siratuti.
FAQ #4 Onde colocar esses pedaços de DNA?
“No genoma, né, dêr!”. Certo, mas como? E será que o genoma é o único lugar que podemos colocar esse novo pedacinho de DNA no micro-organismo que queremos modificar? Não! Existe outro lugar também e ele se chama plasmídeo (quem já jogou BioShock vai soltar umas sinapses a mais agora).
O plasmídeo é um DNA circular presente em várias espécies de seres vivos e é responsável por conter informações valiosas envolvendo a sobrevivência do organismo a fatores externos (como por exemplo sua resistência a um antibiótico), além de ser o principal ator da transferência horizontal de informação genética, ou seja, a passagem de um DNA funcional de um ser vivo para outro sem haver hereditariedade (é aí que o jogo BioShock extrapola isso para seres humanos). Adivinha de onde veio a ideia de usar o plasmídeo como transmissor – “vetor” – de informação genética para modificar as células? Veio exatamente desse mecanismo natural de realizar transferência horizontal de genes que vários micro-organismos possuem, então aproveitamos para fazer a transferência das informações genéticas que nós queremos!
E se vamos usar plasmídeos é preciso extraí-los também! Os plasmídeos são moléculas de DNA assim como os pedacinhos obtidos a partir de um genoma, e multiplicados pela PCR, que vamos introduzir no microorganismo, mas aqui há uma etapa importante durante a extração de DNA onde é feita a separação do conteúdo plasmidial do genômico.
O vídeozinho abaixo tem uma animação no ínicio e depois mostra o procedimento do isolamento do plasmídeo em lab!
[youtube_sc url=”http://www.youtube.com/watch?v=8xEDEJ0DHFA”]
Por Otto Heringer e Viviane Siratuti.























